 Endocrinología
Endocrinología
Hipotiroidismo congénito
Definición
El hipotiroidismo congénito (HC) es la disfunción del eje hipotálamo-hipófisis-tiroideo que ocasiona una producción deficiente de hormonas tiroideas y está presente desde el nacimiento. Esta patología representa la causa más frecuente de discapacidad intelectual prevenible en el mundo, dado que las hormonas tiroideas son cruciales para el crecimiento y desarrollo general, particularmente para el desarrollo cortical cerebral, cerebeloso, axonal y dendrítico, para la sinaptogénesis, mielinización y la migración neuronal durante los primeros tres años de vida. Sin tratamiento oportuno, el HC produce lesiones irreversibles en el sistema nervioso central, por lo que el diagnóstico precoz y el tratamiento inmediato constituyen una urgencia médica.
Detección
La instauración de estrategias para un cribado o pesquisa neonatal (PN) es un gran avance en pediatría y debe ser implementada en toda la población de recién nacidos (RN). Permite el análisis de grandes grupos poblacionales con una excelente relación costo-beneficio (prevención/tratamiento vs. secuelas). Los objetivos son:
- La detección temprana en el momento del nacimiento.
- La confirmación e inicio temprano del tratamiento.
- Un seguimiento del manejo integral y vigilancia del evento por parte de los profesionales competentes.
La mayoría de los R.N con H.C. no presenta signos o síntomas al nacer (solo el 5%), por lo que la aplicación del despistaje masivo permite un diagnóstico precoz y oportuno. Esto se debe a que, al aparecer los síntomas, es posible que ya hayan ocurrido alteraciones irreversibles asociadas a la falla tiroidea. El tiempo óptimo para realizar la pesquisa o despistaje es entre las 24 a 72 horas de vida, preferiblemente después de las 48 horas para evitar los falsos positivos que ocurren por el ascenso fisiológico de la TSH después del corte del cordón umbilical. Si esto no es posible, el periodo máximo recomendado es durante la primera semana de vida. En pacientes con alta precoz o en neonatos que requieren trasfusiones antes de las 24 horas de vida, se debe considerar la posibilidad elevada de falsos positivos. En Venezuela, la Unidad de Estudios y Errores Innatos del Metabolismo y Pesquisa Neonatal de la Fundación Instituto de Estudios Avanzados (IDEA), organismo dependiente del Ministerio del Poder Popular para Ciencia y Tecnología, es la responsable de la implementación del programa, que es gratuito y obligatorio. La muestra se obtiene mediante una punción superficial en el talón, extrayendo unas gotas de sangre que se impregnan en un papel absorbente homologado por ambas caras y se envía al laboratorio. Allí se analiza únicamente la TSH, según lo recomienda el Protocolo de Atención Integral en Salud a Niñas y Niños en el Período Neonatal, del Ministerio del Poder Popular para la Salud (2013). De acuerdo con la información disponible en el sitio web de IDEA, se recomienda consultar la red nacional de hospitales públicos para solicitar la prueba de manera gratuita en los centros materno-infantiles ubicados en los estados de Miranda, Aragua, Anzoátegui, Guárico, Lara, Nueva Esparta, Bolívar, Sucre, Zulia y Trujillo. Adicionalmente, se puede asistir a (IDEA), ubicado en la carretera nacional Hoyo de la Puerta, Baruta, Altos de Sartenejas, Estado Miranda. Para mayor información, se sugiere comunicarse al teléfono 0212-9621010 o enviar un correo electrónico a pesquisaenlinea@idea.gob.ve. En Caracas hay laboratorios privados que ofrecen la prueba de pesquisa neonatal.
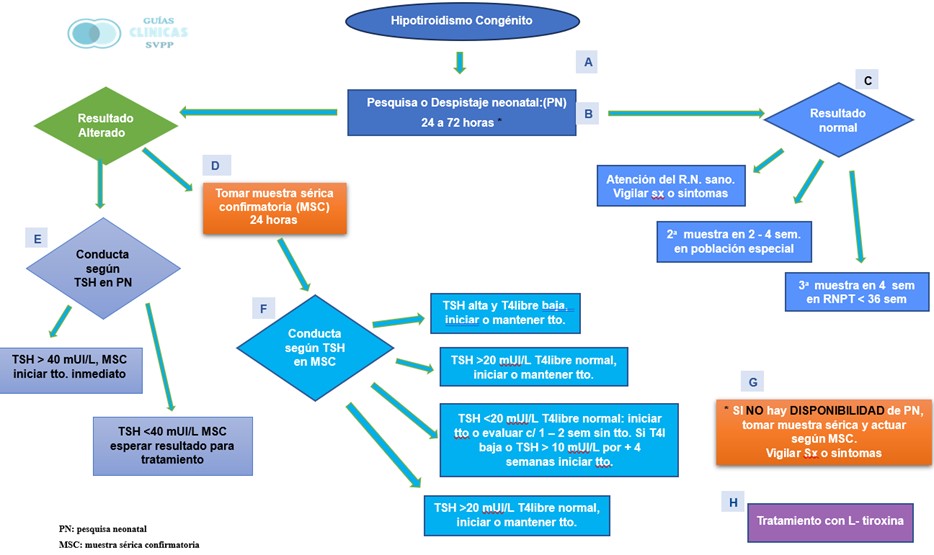
Resultado normal
- Iniciar la atención del R.N. sano según las recomendaciones de la Sociedad Venezolana de Puericultura y Pediatría (SVPP). Si, a pesar de una prueba negativa, en los controles sucesivos recomendados se aprecian signos o síntomas subjetivos de hipotiroidismo congénito (aumento de horas de sueño, fascies tosca, llanto ronco y débil, succión inefectiva, macroglosia, fontanela anterior amplia, fontanela posterior palpable, hernia umbilical, piel seca y moteada, mixedema, palidez o bocio), se debe tomar una muestra sérica confirmatoria (M.S.C.). Si la clínica es marcada o el reporte de los resultados confirmatorios tomará un período mayor a 24 horas, iniciar tratamiento con L-tiroxina oral y suspender si el reporte es normal o continuar si se confirma un H.C..
- En población especial, como recién nacidos con enfermedad aguda (neonatos en unidad de terapia intensiva neonatal, pretérminos menores de 32 semanas, peso muy bajo al nacer menor de 1500 gramos, bebés transfundidos antes de tomar el perfil neonatal, gemelos monocigotos o del mismo sexo, nacimientos múltiples o neonatos con trisomía 21), se debe repetir la prueba de despistaje entre la segunda y la cuarta semana de vida. Si no está disponible la prueba de talón, se puede considerar tomar una muestra sérica.
- En recién nacidos pretérminos menores de 36 semanas, realizar una tercera prueba de pesquisa neonatal cuatro semanas después de la segunda muestra (entre la sexta y la octava semana de vida) o a las 36 semanas de edad corregida. Si no está disponible la prueba de talón, se puede considerar tomar una muestra sérica.
Resultado alterado
Ante un resultado alterado debe tomarse una Muestra Sérica Confirmatoria (MSC) a la brevedad posible, idealmente dentro de las 24 horas posteriores al reporte y solicitar TSH y T4 libre (T4l)
Conducta según el nivel de TSH en la pesquiza neonatal (PN)
- Si el TSH es mayor a 40 mUI/L, iniciar tratamiento con L-Tiroxina oral después de extraer la MSC, sin esperar los resultados.
- Si el TSH es menor a 40 mUI/L, esperar los resultados de la MSC para decidir el inicio de tratamiento con L-Tiroxina oral.
Referir a Endocrinología Pediátrica a la brevedad posible.
Conducta según el nivel de TSH en la muestra sérica confirmatoria (MSC)
- TSH elevada respecto a los rangos de laboratorio, con T4 libre baja, iniciar o continuar tratamiento con L-Tiroxina oral.
- TSH mayor a 20 mUI/L con T4 libre normal, iniciar o continuar tratamiento con L-Tiroxina oral.
- Si la TSH está elevada pero menor a 20 mUI/L y la T4 libre está dentro de los rangos normales, se pueden tomar dos conductas a criterio del tratante:
iniciar tratamiento con L-Tiroxina oral o monitorizar valores de laboratorio cada 1 a 2 semanas sin tratamiento. Si la T4 libre disminuye a valores inferiores al rango mínimo normal o si la TSH permanece elevada con un resultado mayor a 10 mUI/L después de 4 semanas, se recomienda iniciar tratamiento con L-Tiroxina oral.
- Si la TSH es normal o baja y la T4 libre es baja, considerar un hipotiroidismo congénito central o secundario, iniciar L-Tiroxina oral y contemplar otras deficiencias hormonales hipofisarias.
Referir a Endocrinología Pediátrica a la brevedad posible, en el caso de un hipotiroidismo congénito central, la referencia es urgente.
Si la prueba de PN no está disponible
Si no hay material y/o laboratorio disponible para procesar la muestra de despistaje en papel de filtro, se recomienda solicitar una muestra sérica de TSH y T4 libre en los tiempos recomendados, preferentemente antes de la primera semana de vida o al momento de la primera consulta pediátrica, y proceder de acuerdo con las recomendaciones según el resultado de la muestra sérica.
Si tampoco no hay posibilidad de procesar la muestra sérica, se deberá realizar una vigilancia activa de los signos y síntomas subjetivos de H.C, y se derivará al paciente con urgencia en caso de presentarlos. Estos signos y síntomas incluyen: aumento de horas de sueño, fascies tosca, llanto ronco y débil, succión inefectiva, macroglosia, fontanela anterior amplia, fontanela posterior palpable, hernia umbilical, piel seca y moteada, mixedema, palidez o bocio.
Tratamiento
El tratamiento estándar del hipotiroidismo es la levotiroxina (L-tiroxina) por vía oral. La dosis inicial recomendada es de 10 a 15 µg/kg/día. Los bebés con hipotiroidismo congénito severo requieren dosis en el extremo superior del rango, mientras que en aquellos con hipotiroidismo congénito leve, las dosis se calculan hacia el extremo inferior. El tratamiento debe iniciarse idealmente antes de la segunda semana de vida. Las dosis se titulan de acuerdo con los resultados de laboratorio, los cuales se controlan cada 1 a 4 semanas posteriores al inicio del tratamiento, según criterio del especialista. Se debe mantener la lactancia materna sin interrupción.
Las presentaciones de levotiroxina están disponibles en la mayoría de las farmacias del país en tabletas de 25, 50, 100, 125, 150 y 200 µg. En pacientes que no pueden tragar tabletas, se deben administrar trituradas entre dos cucharillas de metal, agregando 2 a 5 ml de agua hervida, leche materna o fórmula sin soya. Solo en recién nacidos y lactantes menores de un año se puede suministrar a cualquier hora del día, pero el horario y la manera de administrarla debe ser consistentes, lejos de medicamentos (hierro, calcio, soya o fibra). No se deben hacer suspensiones caseras o elaboradas en boticas, ya que la suspensión no se homogeniza, por lo que las dosis que se administran de esta manera varían y no se alcanzan niveles séricos adecuados.
AUTORES
Rosa Elena Mora Rivas 1 María Esperanza Velásquez 2
1Coordinadora: Pediatra Endocrinólogo. Unidad de Pediatría IMLF. del IM La Floresta. Caracas. Colaborador Docente de postgrados de pediatría. UCV. 2 Pediatra Endocrinólogo. Jefe del Servicio y director del postgrado de Endocrinología Pediátrica del Hospital “Dr. J.M. de los Ríos”. Caracas.
Nombre autor responsable Rosa Elena Mora Rivas 1
Correo: rosael00@gmail.com
BIBLIOGRAFÍA
- Van Trotsenburg ASP, Stoupa A, Léger J, Rohrer TR, Peters CJ, Fugazzola L, et al. Congenital hypothyroidism: a 2020–2021 consensus guidelines update—an ENDO-European Reference Network initiative endorsed by the European Society for Pediatric Endocrinology and the European Society for Endocrinology. Thyroid. 2021;31(3):387-419.
- Rose SR, Wassner AJ, Wintergerst KA, Yayah-Jones NH, Hopkin RJ, Chuang J, et al; Section on Endocrinology Executive Committee; Council on Genetics Executive Committee. Congenital hypothyroidism: screening and management. Pediatrics. 2023.
- Mora Sitja M, Sanz Fernández M, Carrascón González L, Rodríguez Sánchez A. Revisión de las guías de hipotiroidismo congénito. Novedades en el manejo del hipotiroidismo congénito. Rev Esp Endocrinol Pediatr. 2022;13 Suppl(1):7-12.
- Rodríguez Sánchez A, Chueca Guindulain MJ, Alija Merillas M, Ares Segura S, Moreno Navarro JC, Rodríguez Arnao MD; Grupo de Trabajo de Tiroides de la Sociedad Española de Endocrinología Pediátrica (SEEP). Diagnóstico y seguimiento de los pacientes con hipotiroidismo congénito diagnosticados por cribado neonatal. An Pediatr (Barc). 2019;90(4):250.
- Ministerio de Sanidad, Gobierno de España. Protocolo de cribado neonatal de hipotiroidismo congénito [Internet]. 2021 [revisado 2025 Jul 13]. Disponible en: https://www.sanidad.gob.es/areas/promocionPrevencion/cribado/cribadoNeonatal/enfermedadesEndocrinoMetabolicas/docs/CribadoNeonatal_HipotiroidismoCongenito.pdf
- Wassner AJ. Congenital hypothyroidism guidelines. Medscape Reference [Internet]. 2023 [citado 2024 Jul 5]. Disponible en: https://emedicine.medscape.com/article/919758-guidelines
- Ministerio del Poder Popular para la Salud (MPPS). Protocolos de atención integral en salud a niñas y niños en el período neonatal [Internet]. Caracas: MPPS; 2013 Nov [citado 2025 Jul 13]. Disponible en: https://venezuela.unfpa.org
- Fundación Instituto de Estudios Avanzados (IDEA). Servicio de pesquisa neonatal [Internet]. Caracas: IDEA; [s.f.] [citado 2025 Jul 13]. Disponible en: https://idea.gob.ve/index.php/pesquisa
Cetoacidosis diabética
Definición
La cetoacidosis diabética (CAD) es la emergencia endocrina más frecuente y la complicación metabólica aguda más grave en la edad pediátrica. De acuerdo con la Federación Internacional de Diabetes (FID) cada año se diagnostican en el mundo 149.500 casos nuevos de Diabetes Mellitus tipo 1 (DM1) en menores de 20 años y entre el 15-70% presentan CAD como manifestación inicial de la enfermedad. En quienes ya tienen diagnóstico previo, la CAD constituye la principal causa de reingreso hospitalario, con una incidencia que varía del 1-10% por paciente-año. Asimismo, hasta un 25% de los niños y adolescentes con diabetes tipo 2 pueden debutar con este cuadro. La fisiopatología de la CAD se caracteriza por una deficiencia absoluta o relativa de insulina, acompañada de un incremento en las hormonas contrarreguladoras —glucagón, catecolaminas, cortisol y hormona de crecimiento— que favorecen la hiperglucemia, la cetogénesis y la acidosis metabólica, por ello es fundamental la administración adecuada de insulina en el momento oportuno. Las complicaciones asociadas son diversas, siendo las neurológicas las más temidas. El edema cerebral, con una incidencia reportada entre 0,5 – 0,9%, se asocia a una mortalidad de 21 – 24%. Las complicaciones renales, como la lesión renal aguda, pueden observarse en 43 – 64% de los pacientes. La mortalidad global varía de acuerdo con el nivel de desarrollo del sistema de salud. En países industrializados, la tasa de letalidad es menor al 1%, mientras que en regiones en vías de desarrollo puede alcanzar cifras de 3 – 13%. En la población pediátrica con DM1, la CAD constituye la principal causa de muerte, responsable de más del 50% de los decesos.
Puntos claves del abordaje

Objetivos del tratamiento
Corregir
la deshidratación de manera gradual y segura.
Revertir
la acidosis metabólica y la cetosis.
Restituir
lentamente la osmolalidad plasmática para evitar complicaciones neurológicas.
Alcanzar
valores de glicemia cercanos a lo normal sin descensos bruscos.
Monitorear
y prevenir complicaciones agudas (edema cerebral, alteraciones
hidroelectrolíticas, falla renal).
Identificar
y tratar el evento precipitante (debut, infecciones, omisión de insulina,
estrés metabólico).
Diagnóstico de CAD
- Historia clínica y síntomas
Los síntomas clásicos de DM: poliuria, polidipsia, polifagia y pérdida de peso, suelen estar presentes en la mayoría de los pacientes, pero no en todos.
Otros síntomas y signos sugerentes de CAD: náuseas y vómitos, deshidratación de grado variable, dolor abdominal, aliento cetónico, taquipnea o respiración de Kussmaul, somnolencia o alteración del sensorio.
👉 Importante: no todos los pacientes manifiestan los 4 signos clásicos de DM en el momento del diagnóstico, particularmente los lactantes y preescolares. Por lo tanto, se recomienda medir glucemia capilar en todo paciente pediátrico que acuda a emergencia con vómitos y dolor abdominal sin diarrea, o con taquipnea inexplicada.
- Diagnóstico bioquímico:
Hiperglucemia: glucosa plasmática >200 mg/dL (>11 mmol/L).
Acidosis metabólica: pH venoso <7,0 o bicarbonato (HCO3–) sérico <18 mmol/L.
Cetosis: β-hidroxibutirato (β-OHB) ≥3 mmol/L o cetonuria ≥2+ moderada a importante
El β-OHB es la principal cetona producida y el marcador más útil, pero no está disponible en la mayoría de las emergencias
β -OHB ≥ 3 mmol/L → es un indicador sensible de CAD.
β -OHB ≥ 5,3 mmol/L → tiene una precisión diagnóstica óptima (~91%) en niños con hiperglucemia.
La Cetonuria es más común, pero:
Limitaciones: puede subestimar la gravedad de la cetonemia (solo mide el acetoacetato y cetonas, no el β -OHB)
Falsos positivos por fármacos con grupo sulfhidrilo (captopril, N-acetilcisteína, mesna, penicilamina) o ácido valproico (metabolito con cetonas).
Falsos negativos: tiras reactivas vencidas o mal conservadas.
Manejo general
- Lugar:
El paciente debería ser ingresado o referido a un centro con experiencia en el manejo de CAD, con disponibilidad para:
Monitorización clínica y bioquímica frecuente.
Manejo de líquidos y electrolitos con protocolos estandarizados.
Acceso a personal entrenado en emergencias endocrinológicas pediátricas.
Si esto no es posible, ha de ser ubicado en un área de cuidados especiales, con monitoreo, vigilancia continua y personal de enfermería permanente. Idealmente contar con apoyo por teléfono o videoconferencia de un médico experto en CAD.
- Manejo inicial:
Evaluar ABC (vía aérea, ventilación y circulación).
Medir y registrar: signos vitales, peso actual, puntuación de Glasgow.
Tomar dos vías venosas periféricas, reservar las vías venosas centrales a pacientes graves, por un mayor riesgo de trombosis con su uso.
Obtener muestras para laboratorios iniciales:
Glicemia capilar y sérica.
Gases venosos (no es necesario tomar muestra arterial excepto sospecha de hipoxemia).
Electrolitos (Na+, K+).
Cetonemia (β -OHB) o cetonuria.
Otros laboratorios a considerar: hemograma, urea, creatinina, albúmina, calcio, fósforo, magnesio, HbA1c.
Si hay sospecha de infección: tomar cultivos
Iniciar hidratación intravenosa
- Criterios de ingreso a Unidad de Cuidados Intensivos Pediátricos (UCIP)
Ingresar a UCIP en caso de CAD grave o alto riesgo de lesión cerebral:
Enfermedad actual más larga
Edad <5 años.
pH venoso <7,10.
pCO₂ <21 mmHg (indicador de hiperventilación profunda).
Nitrógeno ureico en sangre (BUN) >21 mg/dL (mayor riesgo de compromiso renal e hipoperfusión).
Deterioro del estado de conciencia o convulsiones.
Inestabilidad hemodinámica o falla orgánica asociada.
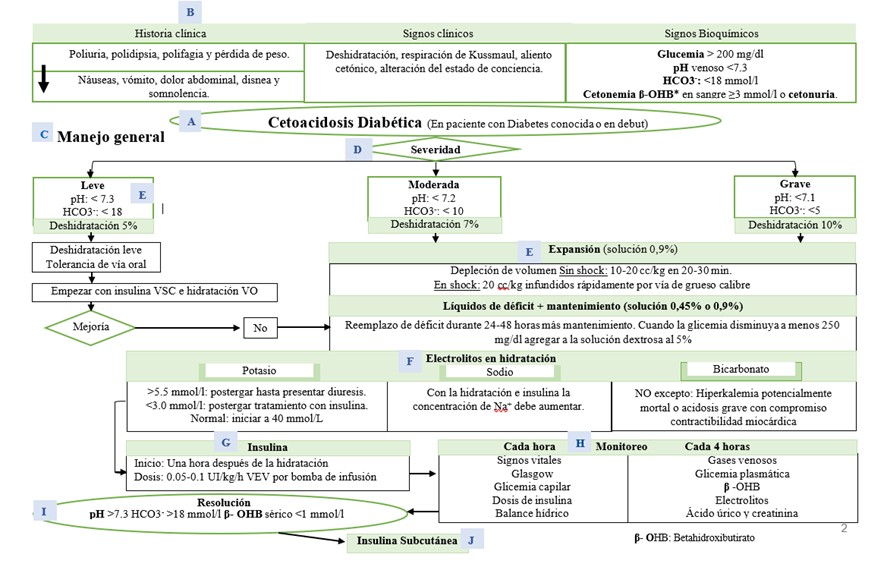
Clasificación según severidad
El siguiente paso es clasificar la severidad del cuadro en base al grado de acidosis metabólica según el pH venoso o capilar y el HCO3– sérico:
Leve:
pH < 7.3 o HCO3– < 18 mmol/L: acidosis metabólica incipiente; el paciente suele estar clínicamente alerta.
Moderada:
pH < 7.2 o HCO3– < 10 mmol/L: compromiso más marcado, con signos clínicos más evidentes (taquipnea notable, letargia, deshidratación).
Grave:
pH < 7.1 o HCO3– < 5 mmol/L: conlleva alto riesgo de complicaciones agudas (como edema cerebral o falla renal).
Reposición de líquidos
Objetivos:
Restituir el volumen circulatorio.
Permitir que la insulina actúe en los órganos blancos.
Resolver los déficits de agua y sodio.
Mejorar filtración glomerular y depuración de glucosa y cetonas.
Los pacientes con CAD tienen una pérdida de líquidos a predominio del espacio extracelular y debe calcularse la cantidad a infundir para lograr su reposición; el shock hemodinámico es poco frecuente en pediatría.
- Cálculo de líquidos totales:
Se estima el Volumen total a administrar según esta fórmula: Volumen total = (Déficit + Mantenimiento) − expansión inicial
1.a . Cálculo de déficit: es la determinación de las pérdidas o del % de deshidratación previo. Su estimación según la clínica del paciente es poco fiable, por lo que se usa la clasificación según la severidad
CAD leve: porcentaje de deshidratación de 5% del peso corporal
CAD moderada: porcentaje de deshidratación de 7% del peso del paciente
CAD grave: porcentaje de deshidratación de 10% del peso total
1.b Cálculo del Mantenimiento: es la cantidad de líquido usuales en la HP, hay una gama de protocolos de hidratación seguros y puede usarse aquel con el que el tratante se encuentre más familiarizado, los más usados son:
Holiday Segar:
Pacientes:
≤ 10 kg: 100 cc/kg/24 h
Entre 11 – 20 kg: 1000 cc + (50 cc/kg/24 h x cada kg)
≥ 20 kg: 1500 cc + (20 cc/kg/24 h x cada kg)
Holiday Segar simplificado
Pacientes:
≤ 10 kg: 4 cc/kg/h
11 – 20 kg: 40 cc + (2 cc/kg/h x cada kg)
>20 kg: 60 cc + (1 cc/kg/h x cada kg)
Método simplificado en > de 10 kg: según la superficie corporal
Mantenimiento de 1500 cc/ m2sc /24 h (se usa 1,5 a 2 veces el basal)
El Volumen total a administrar es la suma del
(Déficit + Mantenimiento) según el método elegido, se le resta la
expansión inicial, y debe iniciarse al menos 1 hora antes de la administración de
la insulina.
CAD leve:
Si hay tolerancia de la vía oral:
Ofrecer hidratación con soluciones orales según esquema habitual
Si no tolera la vía oral:
HP: Déficit del 5% +
Mantenimiento + reposición de K+
En ambos casos:
Iniciar Insulina subcutánea
Análogos de insulina rápida: 0,15
– 0,1 UI/kg/dosis c/2 h
Insulina rápida o cristalina: 0,13
– 0,17 UI/kg/dosis c/4 h
Egreso al revertir la cetosis
Referencia a Endocrinología Pediátrica
CAD Moderada:
HP: Déficit del 7% +
Mantenimiento + reposición de K+
CAD severa
HP: Déficit del 10% +
Mantenimiento + reposición de K+
Administrar una Expansión inicial (bolo):
En Hipovolemia: 10 – 20 cc/kg EV
en 20 a 30 minutos.
En Shock: 20 cc/kg de manera
rápida y repetir hasta restituir volemia (mejoría de la perfusión, de la
taquicardia y de la tensión arterial) )
Se deben usar Cristaloides: solución salina isotónica 0.9%, Ringer Lactato,
Hartmann o Plasmalyte
Restar la expansión al cálculo de los líquidos totales y este total se
administra en 24 o 48 horas
Usar sol isotónica 0.9% o hipotónica 0.45% más solución de K+ (cloruro,
fosfato o acetato)
Añadir Dextrosa al 5% cuando:
La glicemia descienda a niveles entre 250
mg/dl y 300 mg/dl o
El
descenso de glicemia sea > de 90 mg/dl/ en 1 hora
Si es necesario se puede usar Dextrosa al 10%
o 12,5%
en HP preparadas
No
exceder de 4000 cc/m2sc/día
No
reponer pérdidas urinarias
Mantener
perfusión adecuada: a medida que descienden la glucemia y la osmolaridad
plasmática, ocurre una reducción del volumen vascular
Generalmente hay resolución en 12 a 18 horas, si es el caso, el remanente de líquidos calculados
puede administrarse por vía oral.
Reposición de electrolitos
REPOSICIÓN DE POTASIO (K+)
En la CAD hay un déficit de K+ real y también facticio por varios mecanismos, por lo que su reposición SIEMPRE ES NECESARIA DURANTE TODA LA TERAPIA EV.
Al mejorar la acidosis, el K+ reingresa al espacio intracelular y si no se administra adecuadamente, los niveles descenderán rápida y peligrosamente
Se presentan 3 situaciones con conductas diferentes:
NORMOKALEMIA: si el nivel está entre 3,5 – 5,5 mmol:
Indicar 40 mmol de potasio por litro de solución.
Iniciar luego de la expansión y al mismo tiempo que la insulina.
Conducta posterior según valores de laboratorio control.
HIPERKALEMIA: si el valor es >5,5 mmol/l:
Postergar su administración hasta que se documente diuresis.
Iniciar la HP sin K+.
Medir el K+ cada hora y empezar la infusión cuando se logre un nivel <5,5 mmol/l.
HIPOKALEMIA: si el nivel es <3,0 mmol/l:
Postergar el tratamiento con insulina.
Administrar un bolo de K+ junto a la expansión (no más de 0,5 nmol/kg/h) pero por una vía periférica diferente, con monitoreo cardíaco simultáneo.
Si hay disponibilidad, combinar cloruro de potasio con fosfato de potasio o acetato de potasio (50%/50%) para evitar la sobrecarga de cloruro y la asociación de una acidosis metabólica hiperclorémica que, a pesar de no requerir tratamiento, puede interpretarse erróneamente como una cetosis persistente.
SODIO:
Con la administración correcta de soluciones cristaloides, salina isotónica 0,9% o salina hipotónica 0,45% y de la insulina, los niveles de Na+ séricos deben corregirse y mantenerse.
BICARBONATO:
No se han demostrado beneficios clínicos de su uso y podría causar hipernatremia iatrogénica, acidosis paradójica del SNC y una rápida corrección de la acidosis con hipokalemia.
Se debe considerar solo si hay una Acidosis muy severa: pH < 6,9 con compromiso de la contractibilidad cardíaca o hiperkalemia potencialmente mortal.
Insulina
La administración de insulina es primordial, ya que regula el metabolismo, reduce la lipólisis, la cetogénesis y la hiperglicemia, si no se usa correctamente no se revierte la cetosis.
Se prefiere la vía EV por que logra una respuesta más estable, con una reducción más lineal de la glicemia, menor riesgo de hipoglicemias y un ajuste de las dosis más sencillo.
Dosis: 0,05 – 0,1 UI/kg/hora vía EV de insulina Regular o Cristalina, iniciar 1 hora después de comenzar la HP.
En pacientes con pH > 7,15 se puede considerar la dosis de 0,05 UI/kg/hora EV
En pacientes <5 años con CAD leve, la dosis recomendada es de 0,03 UI/kg/hora EV.
Dosis > 0,1 UI/kg/hora pueden provocar una caída rápida del volumen intravascular con compromiso de la perfusión tisular y renal y riesgo de hipokalemia.
Preparación de la infusión: diluir 50 Unidades de Insulina Regular o Cristalina en 50 cc de solución 0,9 % (relación de 1 Ud. por cada cc).
Se debe impregnar el equipo de infusión con la solución preparada antes de usar, no se recomienda administrar por vía central y no debe usarse un bolo de insulina inicial
La insulina R o cristalina por vía EV se mantiene hasta la resolución de la acidosis: pH > 7,30, Bicarbonato > 18 mEq/lt o cierre de anión GAP.
Ajuste de dosis de insulina: se busca que el descenso de la glicemia sea entre y no más de 50 a 100 mg/dl/hora, si la caída es más rápida, se puede disminuir la dosis de insulina a la mitad (0,05 UI/kg/hora) o cambiar a una solución con Dextrosa 5% (Dextro sal 0,45%) o añadir Dextrosa al 5%, 10% o 12,5% a la solución. NO DESCONTINUAR LA INSULINA.
Si no se puede obtener acceso VEV: en CAD leve o moderada sin complicaciones.
- Análogos de insulina de acción rápida (Lispro, Aspart o Glulisina): 0,15 UI/kg/dosis cada 2 horas vía subcutánea
- Insulina rápida o cristalina: 0,13 – 0,17 UI/kg/dosis cada 4 horas con aumento o descenso del 10 al 20 % según glicemia sérica antes de siguiente dosis.
Si el paciente tiene diagnóstico previo de DM y recibe análogos de acción ultra larga (Glargina o Detemir) no descontinuar.
Monitoreo
La vigilancia continua es indispensable para poder hacer ajustes en tratamiento según los datos clínicos o de laboratorio y para identificar posibles complicaciones.
Se recomienda registrar:
Cada hora: signos vitales, escala de Glasgow, glicemia capilar, dosis de insulina, balance hídrico y
Cada 4 horas: gases venosos, glicemia plasmática, β-OHB, electrolitos séricos, ácido úrico y creatinina.
Se recomienda mantener la glicemia alrededor de 200 mg/dl
Si no hay laboratorio para medir el K+ sérico antes o durante tratamiento, usar el ECG para valorar signos sugerentes de hipo e hiperkalemia.
Criterios de resolución
- pH venoso >7,3 HCO3– >18 mmol/l β – OHB en sangre <1 mmol/l
- La cetonuria no debe usarse como criterio de resolución porque se mantiene tiempo después que los niveles de β – OHB se normalizan.
- La CAD suele resolverse en un plazo de 12 horas en casi todos los niños.
- Si no hay mejoría se debe re-evaluar, revisar los líquidos, la insulinoterapia y tener en cuenta otras posibles causas: infección, errores en la preparación de insulina o en la vía de administración o acidosis hiperclorémica (Calcular brecha aniónica o anión GAP).
Brecha aniónica = Na+ – (Cl– + HCO3–): la normal es 12 ± 2 mmol/l, en la CAD suele ser de 20-30 mmol/l; una brecha aniónica >35 mmol/l sugiere una acidosis láctica concomitante.
Insulina vía subcutánea
Al haber mejoría clínica y de la acidosis (CAD leve), la cetonuria puede estar presente.
Probar tolerancia de vía oral, si se logra:
Insulina pre prandial: Indicar antes de una comida y pueden usarse:
Insulina rápida o cristalina: aplicar VSC 30 minutos antes de la comida y entre 30 minutos a 1 hora antes de suspender la infusión EV de insulina cristalina o
Análogos de insulina de acción rápida VSC aplicar 15 minutos antes de la comida y entre 15 a 30 minutos antes de suspender la infusión EV de insulina cristalina
Insulina basal: puede iniciarse 12 horas antes de suspender la infusión de la insulina EV.
Dosis: Pacientes prepuberales: 0,7 a 1,0 UI/kg/día.
Pacientes puberales: 1,0 -2,0 UI/kg/día
La dosis total de insulina se distribuye en insulina basal (30-45 % de la dosis total), es aquella que actúa durante el día sin relación a las comidas y la insulina pre prandial (55-70 %.de la dosis total), aquella que regula la elevación de la glicemia posterior a la ingesta de alimentos.
AUTORES
Berlis Milenis González Olivier 1 Rosa Elena Mora Rivas 2
1Pediatra Endocrinólogo. Clínica Razzeti, Puerto Ordaz. Coordinadora del Programa “Piezas” para el control metabólico de niños con Diabetes en el Centro pediátrico Lala. 2 Pediatra Endocrinólogo. Unidad Pediátrica IMLF. Instituto Médico La Floresta. Caracas. Colaborador docente de postgrado. UCV.
Nombre autor responsable: Berlis Milenis González Olivier 1
Correo: draberlisgonzalez@gmail.com
- Glaser N, Fritsch M, Priyambada L, Rewers A, Cherubini V, Estrada S, et al. ISPAD Clinical Practice Consensus Guidelines 2022: Diabetic ketoacidosis and hyperglycemic hyperosmolar state. Pediatr Diabetes. 2022; 23(7):835-856.
- Rameshkumar R, Satheesh P, Jain P, Anbazhagan J, Abraham S. Low-Dose (0.05 Unit/kg/hour) vs Standard-Dose (0.1 Unit/kg/hour) Insulin in the Management of Pediatric Diabetic Ketoacidosis: A Randomized Double-Blind Controlled Trial. Indian Pediatr. 2021; 58(7):617-623.
- Alsabri M, Rath S, Okaruefe C, Yoo P, Aziz M, Shehada W. Diabetic Ketoacidosis in Pediatric Emergency Medicine: Risk Factors, Myths, and Evidence-Based Management of Complications. Current Emergency and Hospital Medicine Reports. 2025; 13:6.
- Gripp K, Trottier E, Thakore S, Sniderman J, Lawrence S. Current recommendations for management of paediatric diabetic ketoacidosis. Paediatr Child Health.2023; 28(2):128–138.
- Rugg-Gunn Ch, Deakin M, Hawcutt D. Update and harmonization of guidance for the management of diabetic ketoacidosis in children and young people in the UK. BMJ Paediatr Open. 2021; 5(1): e001079.
- Kostopoulou E, Sinopidis X, Fouzas S, Gkentzi D, Dassios Th, Roupakias S. Diabetic Ketoacidosis in Children and Adolescents; Diagnostic and Therapeutic Pitfalls. Diagnostics. 2023; 13, 2602.
- Lazar I, Wizeman-Orlov D, Hazan G, Orbach A, Haim A, Cavari1 Y, et al. The role of anion gap normalization time in the management of pediatric diabetic ketoacidosis. Frontiers in Pediatrics. 2023; vol 11.
- Rewers A, Kuppermann N, Stoner M, Garro A, Bennett J, Quayle K. The Pediatric Emergency Care Applied Research Network (PECARN) FLUID Study Group; effects of Fluid Rehydration Strategy on correction of Acidosis and Electrolyte abnormalities in Children with Diabetic Ketoacidosis. Diabetes Care. 2021; 1(9):2061–8.
EDEMA CEREBRAL: La etiología de la lesión cerebral asociada a la CAD y los regímenes óptimos de tratamiento con líquidos en niños son temas aún en investigación. Inicialmente se postuló que la causa era la administración rápida de líquidos que provoca cambios en la osmolalidad plasmática; sin embargo, la evidencia más reciente sugiere que la hipoperfusión cerebral y el estado hiperinflamatorio causados por la CAD tienen roles fundamentales.
Los signos de lesión cerebral son: cefalea o vómitos posteriores al inicio del tratamiento, disminución de la frecuencia cardíaca no relacionada con el sueño ni con una mejoría del volumen intravascular, cambios en el estado neurológico (irritabilidad, letargo, confusión, incontinencia), signos neurológicos específicos (parálisis de pares craneales) o disminución de la saturación de oxígeno. Estos pacientes deben recibir Manitol al 50% y ser referidos o ingresados a UCIP.
PACIENTES CON OBESIDAD: Si los cálculos de líquidos en estos casos superan los que suelen usarse en adultos, es preferible usar protocolos de líquidos para adultos (p. ej. un máximo de 1 litro por expansión y 500 ml/h de infusión de líquidos).
FÓRMULAS DE INTERÉS:
Osmolaridad efectiva:
2 x (Na+plasma) + (Glicemia mg/dl/ 18) Valor normal: (275 – 295 mOsm/kg
Anión GAP:
Na+ – (Cl– + HCO3) Valor normal: (12 ± 2 nmol/lt)
Sodio corregido: (Na+ plasmático + 1,6) x [ (Glicemia plasmática mg/dl – 100) / 100]
INFORMACIÓN PARA PADRES
Diabetes y Cetoacidosis diabética
¿Qué es la Diabetes?
Es una condición en la que los niveles de azúcar en la sangre (glicemia) permanecen altos debido a la falta de producción de insulina o porque, aunque se produce, no puede cumplir su función de reducirlos.
La diabetes tipo 1 se presenta por la pérdida de la capacidad del páncreas para producir insulina, debido a la destrucción de las células beta (β) por parte de anticuerpos del propio sistema inmunitario. Esta enfermedad es más común en niños y adolescentes.
La diabetes tipo 2 se presenta debido a la resistencia de los tejidos corporales a la acción de la insulina. Su prevalencia ha aumentado con el incremento del número de niños y adolescentes con sobrepeso u obesidad, ya que el tejido adiposo acumulado genera resistencia a la acción de la insulina.
¿Cómo controla la insulina los valores de azúcar en la sangre?
Los tejidos del cuerpo están constituidos por células que se unen para formarlos, de manera similar a las piezas de un rompecabezas. Después de ingerir alimentos, los niveles de azúcar en la sangre aumentan, lo que provoca que el páncreas libere insulina. Esta hormona facilita la entrada de azúcar en las células, donde se utiliza como energía, lo que a su vez reduce los niveles de azúcar en sangre a su valor normal. Entre comidas, el páncreas continúa trabajando, liberando dosis más pequeñas y constantes de insulina para mantener los niveles de azúcar en sangre dentro de un rango normal.
¿Qué signos y síntomas me permiten sospechar el inicio de una diabetes?
Los síntomas pueden variar, pero la presencia de sed excesiva que lleva al niño a ingerir grandes cantidades de agua, aumento de la frecuencia urinaria incluso durante la noche, hambre intensa y pérdida de peso, son señales de que los niveles de glucosa en sangre están elevados. Es importante destacar que no siempre se presentan los cuatro síntomas. Si su hijo presenta alguno de ellos, es fundamental acudir de inmediato a consulta médica.
¿Qué es la cetoacidosis diabética?
Se trata de una complicación grave que puede presentarse en niños con diabetes, tanto en el momento del diagnóstico como en cualquier etapa posterior. Esta condición requiere atención hospitalaria e incluso, dependiendo de su gravedad, atención en una unidad de terapia intensiva.
¿Por qué ocurre la cetoacidosis diabética?
Ante la ausencia de insulina o su imposibilidad para actuar, la glucosa no puede ingresar a las células del cuerpo. El cerebro interpreta esta situación como una falta de energía y, en consecuencia, comienza a tomar proteínas de los músculos y grasa corporal para transformarlas en combustible. Este proceso, además de aumentar significativamente los niveles de glucosa en sangre, genera cuerpos cetónicos que acidifican la sangre.
Esta situación puede presentarse en diversas circunstancias: cuando el diagnóstico de diabetes se retrasa en una persona que está debutando, en un paciente conocido que ha suspendido la administración de insulina o cuando, a pesar de administrarla, la dosis resulta insuficiente en situaciones que requieren una mayor cantidad, como infecciones. También puede ocurrir en niños que utilizan bombas de insulina y estas se detienen inadvertidamente, sin que el niño o sus padres lo noten.
Existe un riesgo significativo cuando un niño o adolescente no mantiene un control metabólico adecuado de su diabetes y presenta glicemias elevadas persistente. Esta situación puede compararse con un vaso que se llena gradualmente hasta que una última gota lo derrama. Por lo tanto, es fundamental mantener los niveles de glucosa en sangre dentro del rango establecido por el endocrinólogo pediatra.
¿Qué síntomas me harían sospechar que estoy frente a una cetoacidosis diabética?
Inicialmente, pueden presentarse síntomas que indiquen niveles elevados de glucosa en sangre: sed excesiva, micción frecuente, hambre intensa, pérdida de peso. Si esta situación persiste durante varios días sin iniciar tratamiento con insulina para detener la formación de cuerpos cetónicos en niños con diagnóstico reciente, o sin corregir las glucemias en pacientes con diabetes preexistente, la acumulación de estos cuerpos cetónicos puede generar otros síntomas que sugieren cetoacidosis diabética. Estos síntomas incluyen: náuseas, vómitos, dolor abdominal, deshidratación, somnolencia, aliento a manzana podrida (aliento cetónico) e incluso dificultad para respirar (respiraciones rápidas y profundas). Si se presentan estos síntomas, es urgente acudir a un servicio de emergencias para determinar el diagnóstico y recibir tratamiento oportuno.
¿Cómo determina el médico que se trata de una cetoacidosis diabética?
Además de los síntomas y signos ya mencionados, la forma definitiva de diagnóstico es a través de pruebas de laboratorio: una glucemia en sangre mayor a 200 mg/dl, cuerpos cetónicos elevados en sangre y/o orina, y gases venosos o arteriales para verificar si el pH de la sangre y el bicarbonato están bajos.
¿Cuál es el mejor tratamiento para la cetoacidosis diabética?
Sin duda, la prevención es fundamental. En el caso de los niños que debutan con diabetes, es crucial que acudan a consulta médica con prontitud para evitar retrasos en el diagnóstico e iniciar de manera oportuna el tratamiento con insulina. En cuanto a los niños con diagnóstico previo de diabetes, es esencial que mantengan un control metabólico constante. Asimismo, tanto ellos como sus familiares deben estar capacitados para identificar los síntomas de una cetoacidosis diabética y acudir de inmediato a un servicio de emergencia con experiencia en el manejo de esta complicación en caso de presentarla.
¿Como lograr un buen control metabólico?
Con la constancia en el cumplimiento diario de las dosis de insulina, una alimentación saludable, actividad física programada, control diario de la glucemia, conocimiento en el manejo de la enfermedad y asistencia regular a los controles de endocrinología pediátrica, nutrición y otras consultas de control y vigilancia de complicaciones crónicas. Un recurso valioso para lograrlo es la aceptación, una actitud positiva frente a esta condición, el apoyo familiar y, sobre todo, una educación continua en diabetes.
Elliot Proctor Joslin, especialista y pionero en el campo de la diabetes decía: “La educación no es una parte del tratamiento de la diabetes, es el tratamiento”